Aromaten: Beschreibung eines Mesomerieenergie-Diagramms und eines Energiediagramms der Bromierung von Benzol - wer kann meine Antwort korrigieren?
Hallo liebe Chemiker in der Community,
von meinem Tutor habe ich die folgenden zwei Aufgaben als Hausarbeit erhalten.
Ich habe diese bereits erledigt, doch vor der Vorstellung hätte ich gerne noch ein kurzes Feedback. Hier meine Lösung:
Aufgabe 7
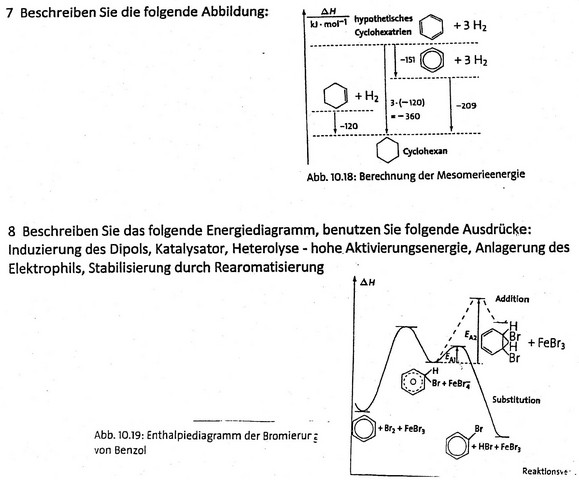
Betrachtet wird in der Abbildung ein Cyclohexan-Molekül. Wird dieses Molekül dehydriert, ergibt sich ein um 120 kJ/mol abgesenkter Energiezustand, welcher die Bindungsenergie um denselben Betrag erhöht.
Verfolgt man dieses Schema weiter, müsste eine dreifache Hydierung des Cyclohexan-Moleküls (es handele sich um ein hypothetisches Cyclohexatrien) zu einem abgesenkten Energiezustand von 360 kJ/mol führen (3* (-120 kJ/mol)) im Vergleich zum Cyclohexan-Molekül. Nach chemischen Messvorgängen mit Cyclohexatrien – die 6 Elektronen sind delokalisiert – erhält man aber anstelle der erwarteten 360 kJ/mol nur einen um 209 kJ/mol abgesenkten Energiezustand zwischen Cyclohexatrien und Cyclohexan.
Die Energie zwischen den Verbindungen mit delokalisierten Elektronen und der hypothetischen Form mit lokalisierten Doppelbindungen beträgt 151 kJ/mol und wird als Mesomerieenergie bezeichnet.
Aufgabe 8
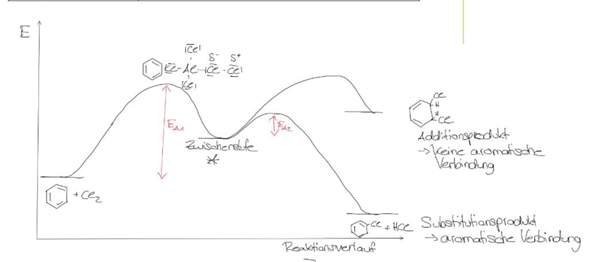
Wenn Benzol unter der Verwendung des Katalysators FeBr3 bromiert wird, wird durch die Näherung des Brom-Moleküls eine Elektronenverschiebung am Benzol-Molekül bewirkt, was widerum die Induzierung eines Dipols zur Folge hat.
Um nun eine Bindungsbildung zu ermöglichen, muss das Br2-Molekül heterolytisch gespalten werden. Dazu muss eine hohe Aktivierungsenergie aufgebracht werden. Nach dem Energie-Erhaltungssatz eines geschlossenen Systemes bewirkt dies eine Absenkung der Energie des Gesamtsystems.
Nun lagert sich das elektrophile, positive Brom-Atom am Benzolring an, was die Bildung eines Carbokations (=> Übergangszustand) und die Bidung von FeBr4- zur Folge hat. Durch Bindungsbildung steigt die Gesamtenergie bekanntlich ein wenig.
Da das Carbokation sehr unstabil ist, wird ein positives H-Atom abgespalten (Bindungsspaltung benötigt Energie), welches sich an den negativ geladenen Katalysator anlagert.
Die weitere Abspaltung von Bromwasserstoff des Katalysators benötigt erneut Energie weshalb die Energie des Systems weiter absinkt.
Letztendlich liegt durch die Rearomatisierung ein stabiles System vor.
______________________
Im voraus bedanke ich mich vielmals!
Grüße, carbonpilot01